TIPHANIE AUDELAN, GILLES MARTIN, EMMANUEL MARCIANO, PERRINE GILLARD, GEORGES AZAR, ISABELLE COCHEREAU, ERIC GABISON, AND SERGE DOAN
(Am J Ophthalmol 2022;237: 13–21. © 2021 Elsevier Inc. All rights reserved.)
- Objectif: Décrire les signes cliniques, meibographiques et interférométriques chez les enfants atteints de rosacée oculaire.
- Conception : Étude prospective cas-témoins.
- Méthodes : Cette étude monocentrique menée à la Fondation Ophtalmologique Rothschild (Paris, France) a porté sur 42 enfants atteints de rosacée oculaire et 44 volontaires sains (âges médians de 10 et 11 ans, respectivement) qui ont fait l’objet d’une meibographie infrarouge de leurs paupières inférieures et de mesures de l’épaisseur de la couche lipidique des larmes à l’aide du dispositif LipiView II (Tearscience). La sévérité clinique a été évaluée sur une échelle de 0 à 4 et comparée aux meiboscores (plage de 0 à 4) et à l’épaisseur de la couche lipidique du film lacrymal (plage de 0 à 100 nm).
- Résultats : Sept patients présentaient une atteinte unilatérale et 29 une forme asymétrique. Vingt-quatre patients avaient une rosacée cutanée associée. Dix des 84 yeux présentaient une perte de vision <20/25. Le degré de gravité clinique moyen était de 2,5 ± 1,4. Les anomalies meibographiques étaient significativement plus importantes chez les enfants atteints de rosacée oculaire (meiboscore moyen 2,1 ± 1,36) que chez les volontaires sains (0,61 ± 0,78, P < 0,001). La sévérité clinique (r = 0,44, P < 0,001), la durée de la maladie (r = 0,28, P = 0,011) et les antécédents de chalazion (r = 0,30, P = 0,006) étaient corrélés à la sévérité meibographique. L’épaisseur moyenne de la couche lipidique n’était pas significativement différente entre les cas et les témoins (74,4 ± 18,7 nm et 76,6 ± 18 nm, respectivement, P = 0,47).
- Conclusion : Les altérations de la structure meibomienne chez les enfants peuvent être graves et sont corrélées à la sévérité de la rosacée oculaire. La meibographie est un outil essentiel pour le diagnostic et le suivi, alors que la contribution de l’interférométrie du film lacrymal est incertaine.
La rosacée oculaire est un trouble chronique caractérisé par une blépharite antérieure et postérieure, une mebomite et une inflammation de la cornée et de la conjonctive. La présence d’un chalazion de facon récurrente est un signe (1,2). L’atteinte cornéenne est principalement inférieure et peut inclure une kératite ponctuée superficielle, des infiltrats cornéens, des cicatrices cornéennes, ainsi que la présence d’une néovascularisation cornéenne.
La rosacée oculaire pédiatrique est une forme rare de la maladie, souvent sous-diagnostiquée par les ophtalmologistes (3). La maladie est asymétrique, peut se manifester dès la naissance, évolue en général pendant quelques années, et peut se résorber spontanément ou sous traitement (4,5). Si elle n’est pas traitée, elle peut altérer la vision en raison de la présence d’un astigmatisme irrégulier et de cicatrices cornéennes centrales, qui peuvent être hautement amblyogènes (6). Deux stades sont décrits : la blépharite chronique, la forme la plus fréquente et la moins sévère de la maladie, caractérisée par la présence de chalazion ; et la kératoconjonctivite phlycténulaire, décrite par Thygeson et ses collaborateurs (7), moins fréquente mais plus sévère et définie par la présence de phlycténules, qui sont de petites vésicules au niveau de la conjonction bulbaire, du limbe et de la cornée. Les complications cornéennes sont fréquentes à ce stade.
La physiopathologie de la rosacée oculaire comprend l’inflammation et l’obstruction des glandes de Meibomius, ainsi que la présence de bactéries telles que Staphylococcus aureus, Staphylococcus epidermidis et Propionibacterium acnes. De plus, de nouvelles études ont établi un lien entre la rosacée oculaire et les bactéries associées aux acariens Demodex, des habitants microscopiques de la peau normale qui ont tendance à être beaucoup plus nombreux chez les personnes atteintes de rosacée (1).
Le dysfonctionnement des glandes de Meibomius (MGD), qui entraîne des troubles de la surface oculaire en raison d’anomalies de la couche lipidique, joue un rôle majeur dans la physiopathologie de la rosacée oculaire. Au cours des dernières années, de nouvelles techniques d’imagerie ont vu le jour pour évaluer cliniquement le DGM. Il s’agit notamment de la meibographie infrarouge, de l’interférométrie de la couche lipidique des larmes, de l’évaporimétrie (8), de la microscopie confocale in vivo des glandes de Meibomius et de la meibométrie. Alors qu’il existe une littérature considérable avec de grandes populations sur la meibographie et l’interférométrie chez les adultes présentant une rosacée oculaire, les publications disponibles dans la population enfantine restent rares. Dans ce but, nous avons évalué la maladie en réalisant une meibographie et une interférométrie chez des enfants et nous avons comparé ces résultats avec des individus sains du même âge. De plus, nous avons également essayé de trouver une corrélation statistique entre la sévérité de la maladie sur le plan clinique, méibographique et interférométrique.
PATIENTS ET MÉTHODES
CONCEPTION DE L’ÉTUDE : Dans cette étude prospective cas-témoins monocentrique, nous avions prévu d’inclure 50 enfants atteints de rosacée oculaire et 50 volontaires sains de même âge qui se sont présentés au service d’ophtalmologie de la Fondation ophtalmologique Rothschild, Paris, France, entre avril 2018 et avril 2020. Le protocole a été approuvé par le Comité national d’éthique de la recherche, enregistré à l’Agence nationale de sécurité du médicament (ID-RCB 2017- A03067-46), et a respecté les principes de la Déclaration d’Helsinki. L’étude a été enregistrée sur http://www. clinicaltrials.gov, référence NCT03479853.
Les principaux critères d’inclusion étaient l’âge, entre 2 et 16 ans, le fait d’être couvert par une assurance maladie et le consentement d’un ou des deux parents. Les enfants devaient présenter une rosacée oculaire ou oculocutanée pure. Le diagnostic de rosacée oculaire a toujours été établi par le même examinateur (SD). Il était basé sur des antécédents médicaux de chalazion récurrent, la présence d’une DGM et/ou d’une blépharite, d’une kératoconjonctivite phlycténulaire, de cicatrices cornéennes et d’une néovascularisation. Les sujets témoins devaient être exempts de toute maladie palpébrale ou meibomienne. Les témoins ont été associés en fonction de leur âge (2-4, 5-7, 8-10, 11-13 et 14-16 ans). Les critères d’exclusion étaient le refus de l’enfant de participer à l’étude et l’incapacité de subir et/ou d’interpréter les données meibographiques et interférométriques.
COLLECTE DES DONNÉES ET RÉSULTATS CLINIQUES : Pour chaque patient présentant une rosacée, les données cliniques suivantes ont été rapportées pour chaque œil : temps écoulé depuis l’apparition des premiers symptômes, mesure de la meilleure acuité visuelle corrigée, traitements médicaux antérieurs, antécédents de chalazion, lagophtalmie (occlusion partielle des paupières) et présence de symptômes tels que rougeur, photophobie ou irritation. En outre, les signes suivants ont été notés de 0 à 4 : phlycténules conjonctivales, rougeur de la conjonctive bulbaire et palpébrale inférieure, néovascularisation périphérique cornéenne, infiltrats cornéens, cicatrices cornéennes, néovaisseaux cornéens, kératite ponctuée superficielle, blépharite antérieure (impliquant la peau et les cils), rougeur du bord postérieur de la paupière, kératinisation du bord de la paupière, taux de glandes de Meibomius non affecté par la rosacée, et viscosité du meibum après compression du bord inférieur de la paupière.
Un score global de sévérité clinique a ensuite été défini comme suit : grade 0 = pas de DGM ; grade 1 = DGM avec ou sans blépharite, avec ≥1 antécédent de chalazion, et aucune inflammation de la surface oculaire ; grade 2 = DGM avec phlycténules conjonctivales sans atteinte cornéenne ; grade 3 = atteinte cornéenne légère et périphérique, définie par une kératite superficielle périphérique, une néovascularisation, des infiltrats ou des cicatrices, sans perte de vision conséquente ; et grade 4 = atteinte cornéenne sévère et centrale, et/ou perte de vision inférieure à 70/100, et/ou inflammation cornéenne centrale, néovascularisation ou cicatrices. Les données cliniques recueillies dans le groupe témoin comprenaient l’évaluation de la meilleure acuité visuelle corrigée et la présence d’une lagophtalmie.
Pour chaque œil, une méibographie infrarouge et une interférométrie de la couche lipidique des larmes ont été réalisées à l’aide de l’interféromètre de surface oculaire LipiView II développé par TearScience.
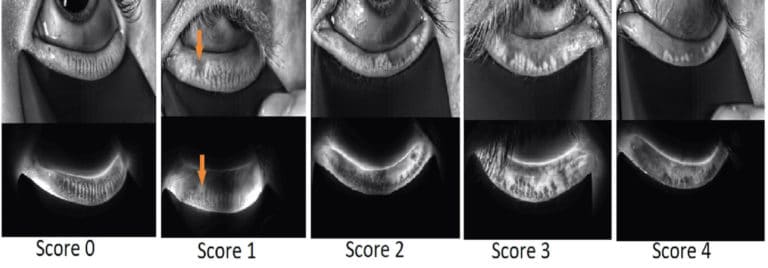
Le score de sévérité meibographique, également appelé meiboscore, a été défini comme le taux de perte des glandes de Meibomius des paupières inférieures (9-14). Cette perte partielle ou complète des glandes de Meibomius est considérée comme une conséquence de la DGM obstructive. Elle ne tient pas compte des anomalies de la morphologie des glandes, telles que la dilatation ou la tortuosité. La perte a été notée pour chaque paupière (figure 1) comme suit : grade 0 (aucune perte de glandes de Meibomius), grade 1 (la zone caractérisée par la perte de glandes représentait 1-24 % du total des glandes de Meibomius), grade 2 (la zone caractérisée par la perte de glandes représentait 25-49 % du total des glandes de Meibomius), grade 3 (la zone caractérisée par la perte de la glande représentait 50-74% du total des glandes de Meibomian), et grade 4 (la zone caractérisée par la perte de la glande représentait 75-100% du total des glandes de Meibomian). Cette évaluation du score a été réalisée à l’insu du même investigateur (SD).
Le score d’interférométrie, défini comme l’épaisseur moyenne de la couche lipidique du film lacrymal (LLT), un nombre compris entre 0 et 100 nm, a été calculé par l’interféromètre.
Enfin, les clignements totaux et partiels pendant l’examen ont également été rapportés.
ANALYSE STATISTIQUE : Les données cliniques ont été analysées à l’aide de statistiques de fréquence et descriptives. Les analyses statistiques ont été réalisées avec le langage de programmation statistique R (version 3.4.2 ; R Project for Statistical Computing). Toutes les caractéristiques démographiques et les résultats ont été présentés sous forme de tableaux.L’homogénéité des 2 groupes a été vérifiée par un test de Wilcoxon- Mann-Whitney. Les résultats meibographiques, interférométriques et de clignement des deux groupes ont été comparés à l’aide d’un test de Wilcoxon- Mann-Whitney. Un coefficient de corrélation de Pearson a ensuite été calculé entre les scores cliniques, meibographiques et interférométriques. Enfin, la signification statistique a été fixée à P ≤ 0,05 à un niveau de confiance de 95 %, le cas échéant.
RESULTATS
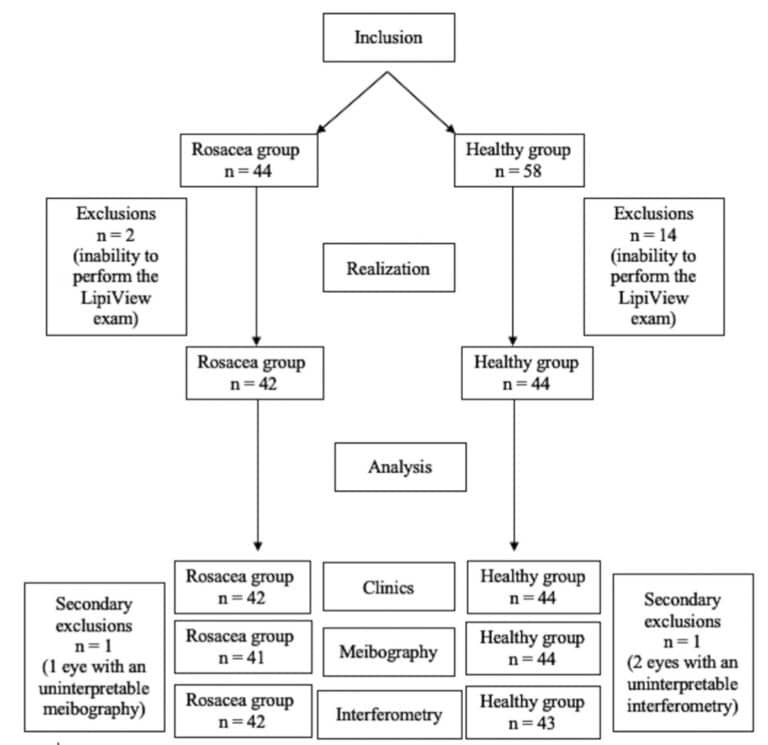
CARACTÉRISTIQUES DE LA POPULATION : Nous avons inclus 44 cas et 58 volontaires sains entre avril 2018 et mars 2020 (figure 2). La plupart des cas (85%) ont été référés par un ophtalmologiste avec le diagnostic de rosacée oculaire, mais le traitement n’était pas précis. Les traitements précédents comprenaient principalement l’hygiène des paupières et de courtes cures de stéroïdes topiques, et moins fréquemment des antibiotiques topiques ou oraux. Aucun des enfants n’a reçu de cyclosporine topique au moment de la référence.
Environ 10% des cas ont été référés avec un diagnostic erroné d’allergie oculaire. Ces patients ont été traités avec des antihistaminiques topiques et/ou des stabilisateurs de lymphocytes, et des stéroïdes topiques pendant les poussées. Environ 5% des cas ont été référés avec un diagnostic d’ulcère ou de cicatrice cornéenne bactérienne.
Deux cas et 14 sujets témoins ont été exclus parce qu’ils n’étaient pas en mesure de se soumettre à l’examen LipiView : 2 cas et 5 sujets témoins étaient trop jeunes et non coopératifs, et 9 sujets témoins ont jugé le temps d’attente avant l’examen trop long. La meibographie et l’interférométrie n’étaient pas interprétables dans 1 œil atteint de rosacée et 1 œil témoin, respectivement. L’âge moyen lors de la consultation était de 10,17 ± 3,28 ans (intervalle 4-16) dans le groupe rosacée et de 10,23 ± 3,35 ans (intervalle 4-16) dans le groupe témoin. Les deux groupes étaient identiques en ce qui concerne les critères d’âge (P = 0,96).
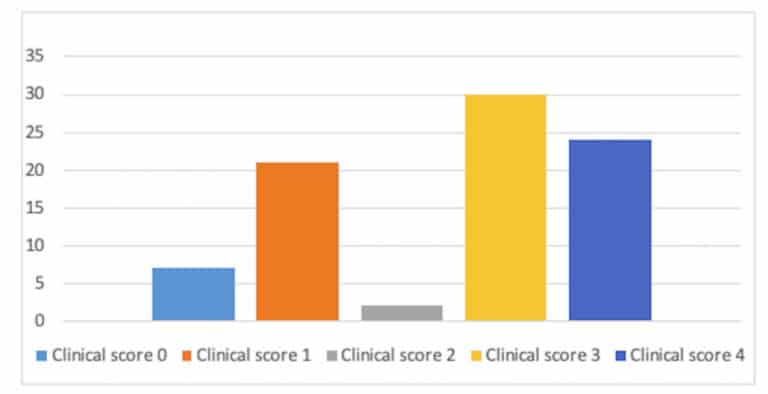
RÉSULTATS CLINIQUES : Les scores de sévérité clinique ont été répartis comme indiqué dans la figure 3. Vingt et un des 84 yeux (25 %) ont présenté un score clinique de 1, 2 des 84 yeux (2,4 %) un score clinique de 2, 30 des 84 yeux (35,7 %) un score clinique de 3, et 24 des 84 yeux (28,6 %) un score clinique de 4. Le score moyen de gravité clinique était de 2,5 ± 1,4. Par définition, ce score était de 0 chez les volontaires sains. Sept patients (16 %) avaient une rosacée oculaire unilatérale (c’est-à-dire un œil avec un score clinique de 0) et 29 patients (69 %) avaient une maladie asymétrique. Au total, la durée moyenne de la maladie était de 5 ans (de 0 à 11 ans).
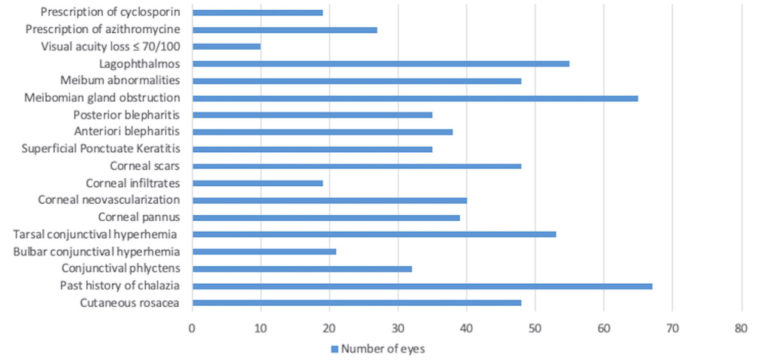
Les signes cliniques présentés par les 84 yeux sont illustrés dans la figure 4. Dans l’ensemble, les patients du groupe rosacée présentaient une maladie active et sévère. Cependant, seuls 10 des 84 yeux (11,9 %) présentaient une perte de vision significative (meilleure acuité visuelle corrigée ≤70/100). La perte de vision était toujours liée à l’état de la cornée (cicatrice ou infiltrat cornéen). L’acuité visuelle moyenne dans le groupe rosacée était de 92 sur 100 (intervalle interquartile 1, médiane 100/100).
En ce qui concerne les signes cliniques de la MGD, 34 yeux (40,5 %) ne présentaient aucune blépharite, tandis que 66 yeux (78,6 %) présentaient une meibomite, dont 65 (98,5 %) une obstruction des glandes de Meibomius et 48 (72,7 %) un meibum pathologique à la compression des paupières. Le meibum pathologique et le taux de glandes obstruées étaient fortement corrélés au score clinique ([r = 0,30, P = 0,005] et [r = 0,49, P < 0,001], respectivement).
Vingt-quatre des 42 patients (57,1 %) présentaient une rosacée oculocutanée, et 19 des 42 patients (45,2 %) avaient ≥1 parent présentant des lésions cutanées de rosacée. Cinquante-cinq des 84 yeux malades (65,5 %) présentaient une lagophtalmie, contre seulement 2 des 88 yeux sains (2,3 %) dans le groupe témoin (P < 0,0001). Le score médian de gravité clinique des yeux lagophtalmiques était de 3 (intervalle interquartile 2,5, moyenne 2,7 ± 1,2) versus 2 pour les yeux qui présentaient une fermeture complète des paupières à l’examen clinique (intervalle interquartile 3, moyenne 2,1 ± 1,5). Enfin, l’âge n’était pas significativement lié à la sévérité clinique (r = -0,07, P = 0,49).
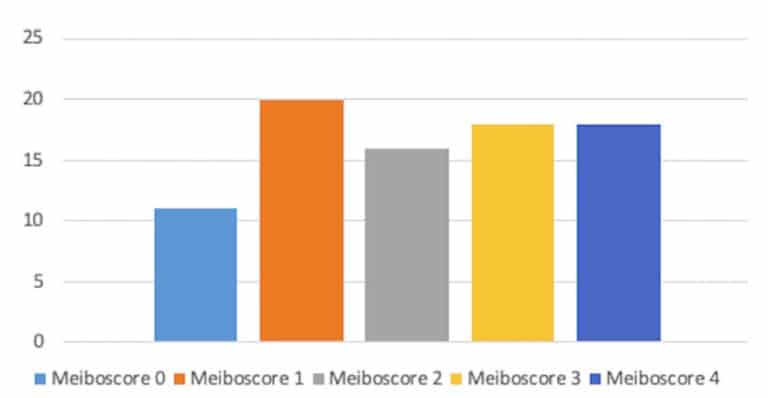
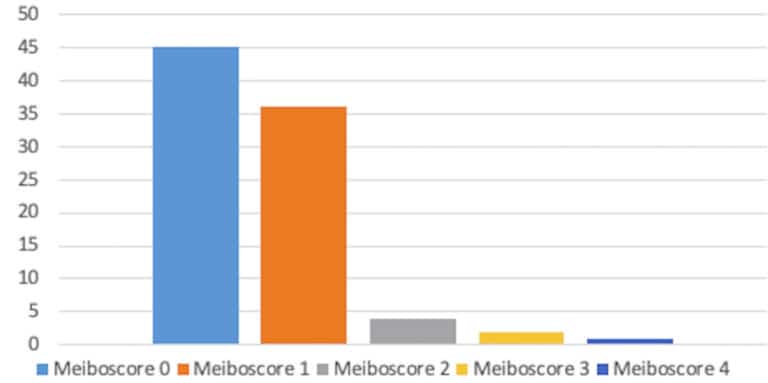
RÉSULTATS MEIBOGRAPHIQUES : Dans l’ensemble, le meiboscore moyen dans le groupe rosacée (figure 5) était de 2,1 ± 1,36 (intervalle 0-4), parmi lesquels 27 des 41 patients [65,8%] avaient un meiboscore différent entre les deux yeux. Quarante-trois yeux (48,9 %) du groupe témoin (figure 6) présentaient des anomalies meibographiques, avec un meiboscore moyen significativement plus faible de 0,61 ± 0,78 (intervalle 0-4, P < 0,00001). Un patient présentait une méibographie pathologique élevée dans les deux yeux (meiboscore 3 et 4) dans le groupe témoin. En examinant plus en profondeur les antécédents médicaux, ses parents ont finalement signalé un historique de chalazion chronique. Par conséquent, ce patient n’aurait pas dû être considéré comme un sujet volontaire sain.
La corrélation entre le score de sévérité clinique et le score de la meibographie chez les enfants atteints de rosacée oculaire était significativement positive (r = 0,44 [intervalle de confiance à 95 % 0,25-0,60], P < 0,001). De plus, le meibum anormal (r = 0,35, P = 0,001) et l’obstruction des glandes (r = 0,54, P < 0,0001) étaient également fortement corrélés avec le score de la meibographie. Cependant, certaines disparités ont été signalées dans l’analyse statistique. En effet, un œil avec un score clinique de 4 ne présentait aucune perte de glande à la meibographie, alors que deux yeux avec un score clinique de 1 présentaient une perte de glande sévère.
Les patients ayant ≥1 épisode de chalazion avaient un meiboscore plus élevé que ceux sans antécédents de chalazion (P < 0,0001), et il y avait une corrélation significative entre la sévérité meibographique et les antécédents de chalazion (r = 0,30, P = 0,006). Les patients atteints de blépharite postérieure présentaient un meiboscore significativement plus élevé que ceux sans blépharite (P < 0,001). La durée de la maladie, estimée par le temps écoulé depuis le premier chalazion, était statistiquement corrélée à la sévérité meibographique (r = 0,28, P = 0,011).
Enfin, l’âge n’était pas corrélé à la sévérité de la meibographie, ni dans le groupe atteint de rosacée (r = 0,02, P = 0,84) ni dans le groupe témoin (r = 0,19, P = 0,07), et les meiboscores des patients lagophtalmiques atteints de rosacée oculaire n’étaient pas significativement différents de ceux des patients non lagophtalmiques (P = 0,51).
RÉSULTATS DE L’INTERFÉROMÉTRIE
Les résultats de l’interférométrie ont été analysés chez 83 yeux malades et 86 yeux sains. L’épaisseur médiane de la couche lipidique (LLT) était de 75 nm dans les deux groupes, ce qui est considéré comme une épaisseur normale.(15) L’épaisseur moyenne dde cette couche dans le groupe atteint de rosacée était de 74,4 ± 18,7 nm, contre 76,6 ± 18,1 nm dans le groupe témoin (P = 0,47).
Même dans le sous-groupe des patients cliniquement sévères (24 yeux), le LLT moyen s’est avéré normal (80,25 ± 17,3 nm). Sept yeux avec un score clinique de 4 ont conservé un LLT maximal de 100 nm. En revanche, certains patients présentant une faible valeur interférométrique étaient cliniquement asymptomatiques (patient 41, 35 nm avec un score clinique de 0 et un meiboscore de 1).
Dans le sous-groupe le plus sévère du point de vue meibographique (18 yeux), le LLT moyen était de 68,9 ± 21,2 nm, ce qui est presque normal. Deux yeux avec un meiboscore de 4 avaient un LLT maximal de 100 nm. A l’inverse, certains patients avec une valeur interférométrique faible présentaient des meibographies avec une perte de glande quasi nulle.
Il n’y avait pas de corrélation entre l’interférométrie peu élevée d’une part et la sévérité clinique ou meibographique d’autre part (r = 0.11, P = .33 et r = -0.12, P = .26, respectivement). Enfin, la LLT était corrélée avec un mauvais meibum (r = -0.24, P = .03) mais pas avec l’obstruction de la glande (r = -0.06, P = .56).
Le rapport d’interférométrie de l’appareil a également permis l’étude des clignements. Le taux moyen de clignement partiel n’était pas statistiquement différent entre le groupe rosacée et le groupe témoin (62,2 % ± 37,3 % et 56,1 % ± 35,5 %, respectivement, P = 0,22). Ce taux de clignement partiel n’était pas statistiquement différent même dans les sous-groupes cliniquement ou meibographiquement les plus sévères (P = 0,30 et P = 0,65, respectivement).
DISCUSSION
RÉSULTATS CLINIQUES : Concernant les caractéristiques démographiques de notre étude, la légère prédominance féminine dans le groupe rosacée par rapport aux sujets témoins s’explique par la légère prédominance féminine de la maladie. Le sex-ratio dans la littérature publiée est le même que celui observé ici. La rosacée cutanée est plus fréquente chez les garçons,(3,5) alors que la rosacée oculaire semble toucher autant les garçons que les filles.(3,16,17)
Nous avons trouvé une rosacée cutanée associée à une rosacée oculaire chez 24 patients (57,1%), ce qui correspond aux résultats présentés dans la littérature publiée. Cependant, comme la plupart des études concernent un petit nombre de patients, surtout en pédiatrie, ces résultats sont difficilement extrapolables à la population générale. Donmez et Akova(18) ont rapporté une rosacée cutanée associée chez 8 des 16 patients (50 %, âge moyen 7,7 ans), Gonser et associés(17) ont identifié 16 des 19 patients (84,2 %, âge moyen 8,6 ans), tandis que Jones et associés(19) ont identifié 3 des 27 patients (11 %, âge moyen 6,9 ans) avec des signes cutanés.
En ce qui concerne l’examen clinique, un chalazion antérieure (79,7%) et une meibomite (78,6%) étaient les signes cliniques les plus fréquents de la maladie. La malocclusion palpébrale était également l’une des constatations les plus fréquentes dans notre cohorte (69%). Lorsqu’elle était présente, elle était le plus souvent bilatérale. Les ophtalmologistes devraient prêter attention à la lagophtalmie plus souvent. Tout d’abord, indépendamment de toute MGD, elle aggrave la kératite superficielle inférieure, la coloration conjonctivale inférieure et la néovascularisation inférieure.Ensuite, les canaux des glandes sur le bord de la paupière sont constamment exposés à l’air et sont plus enclins à la kératinisation. Enfin, les conduits des glandes ne bénéficient pas de la pression des paupières pendant les clignements, car la malocclusion palpébrale entraîne également des clignements partiels(20).
Nous avons démontré que la rosacée oculaire est une maladie potentiellement grave chez les enfants : une perte visuelle significative a été trouvée dans 12% des yeux, 57% présentaient une cicatrice cornéenne (avec ou sans impact visuel selon la localisation de la cicatrice), et 22,6% avaient besoin d’un médicament immunosuppresseur topique. Cependant, il peut y avoir un biais car la cohorte provient d’un recrutement hautement spécialisé (biais de sélection d’un centre tertiaire unique où les patients les plus sévères sont envoyés).
En termes de méthodologie, outre le recrutement prospectif, l’un des atouts de cette étude est que les classements cliniques et meibographiques ont été effectués par le même investigateur (SD), ce qui réduit tout biais de mesure. De plus, la taille de cette étude est l’une des plus importantes disponibles sur la rosacée oculaire chez l’enfant.
RÉSULTATS MEIBOGRAPHIQUES : Tout d’abord, cette étude a montré que la chute de la glande meibomienne peut être importante. Nous avons observé des meibographies avec une perte de plus de 75 % des glandes, même chez les jeunes enfants. Ce résultat est intéressant car les glandes de Meibomius sont connues pour ne pas pouvoir se régénérer : les meibographies de ces patients ne feront qu’empirer avec le temps.
Comme indiqué précédemment, le taux élevé de perte de glande observé peut s’expliquer par un biais de recrutement : les patients ont été adressés à un centre tertiaire en raison de la gravité de leur maladie et de leur résistance aux traitements habituels. La majorité des yeux inclus avaient une expérience de chalazion à répétition, avec une durée médiane de la maladie de 5 ans.
Dans notre étude, seules les paupières inférieures ont été évaluées par meibographie. Finis et associés(21) et Al-Hayouti et associés(22) ont démontré que les meibographies inférieures sont suffisantes pour l’évaluation de la perte globale des glandes meibomiennes. Ils ont trouvé une forte corrélation entre le meiboscore de la paupière inférieure et le meiboscore global des deux paupières (r = 0,892, P < 0,0001) dans une population de 128 adultes.(21) Dans une population plus petite de 31 enfants atteints de rosacée oculaire (âge médian 10,6 ans) et de 32 enfants en bonne santé (âge médian 11,4 ans), Al-Hayouti et ses associés(22) ont également prouvé que la perte des glandes de la paupière supérieure et inférieure n’est pas significativement différente. Même si ces études ont montré que la meibographie de la paupière inférieure est suffisante pour évaluer l’atteinte globale de la glande de Meibomius, certains auteurs décrivent la perte de la glande de la paupière inférieure comme plus sévère que la perte de la glande de la paupière supérieure(23,24).
Nous avons trouvé une forte corrélation entre la sévérité clinique et la sévérité meibographique. A notre connaissance, ceci n’a jamais été démontré auparavant dans la rosacée oculaire chez l’enfant. Nos résultats complètent la littérature déjà disponible sur la rosacée oculaire.
Chez les enfants, Al-Hayouti et ses collaborateurs(22) ont démontré que les meiboscores des paupières inférieures et supérieures des yeux malades sont significativement plus élevés que ceux des yeux sains (P < .001). La perte partielle et totale des glandes était également significativement plus élevée dans le groupe malade que dans le groupe sain. Le taux de distorsion des glandes n’était pas significativement différent entre les deux groupes. Cependant, la corrélation entre les signes cliniques et les meiboscores n’a pas été étudiée. Chez les adultes, Machalinska et ses associés(25) ont étudié 41 patients atteints de rosacée cutanée et ont trouvé une corrélation entre les anomalies cliniques du bord de la paupière et la perte de glande meibographique (r = 0,30, P = 0,005).
Nous avons trouvé une corrélation hautement significative entre les grades de sévérité clinique et la perte des glandes meibomiennes à la meibographie. Cependant, certains cas ne présentaient pas de corrélation. Certains patients avaient un score clinique faible (0 ou 1) et une meibographie montrant une perte élevée de glandes. Ceci peut s’expliquer par la variabilité des signes cliniques dans le temps, alors que l’atrophie meibomienne est définitive. Ces cas de discordance ont dû présenter des lésions cornéennes sévères plus tôt, avec une récupération complète, alors que leurs glandes meibomiennes gardent les stigmates de leur histoire.
D’autre part, certains enfants présentant une maladie clinique sévère avaient un meiboscore bas. La première hypothèse est que lorsque ces enfants sont traités suffisamment tôt, la chute des glandes meibomiennes peut être limitée. Deuxièmement, un score de meiboscore normal n’exclut pas une obstruction partielle des glandes(26, 27) qui, dans ce cas, soit n’est pas détectable à la meibographie, soit se manifeste par des anomalies morphologiques telles qu’une dilatation et une tortuosité, qui ne sont pas prises en compte par le score de meiboscore.
De manière surprenante, les enfants en bonne santé présentaient fréquemment une atrophie meibomienne légère. En effet, 43 des 88 yeux sains (48,8 %) du groupe témoin présentaient un meiboscore ≥1 dans notre série. Cela rappelle les résultats de Gupta et associés(28), qui ont constaté que les enfants asymptomatiques pouvaient avoir un taux significatif de perte de glande meibomienne.Dans leur rapport, ils ont étudié 99 yeux de 99 enfants âgés de 4 à 17 ans (âge moyen de 9,6 ans). Quarante-deux pour cent d’entre eux avaient un meiboscore ≥1 (sur une échelle de 0 à 4). Le meiboscore moyen de leur cohorte était de 0,58 ± 0,80, ce qui correspond à celui retrouvé dans notre étude (meiboscore moyen 0,61 ± 0,78).
Chez Al-Hayouti et ses collaborateurs(22), les meiboscores, la perte totale ou partielle des glandes et la distorsion des glandes des sujets témoins ont également été notés.
Cette étude n’a pas trouvé de corrélation significative entre l’âge et l’atrophie meibomienne, ce qui correspond à d’autres résultats trouvés dans la littérature publiée.(28-30) Cependant, nous avons trouvé une corrélation significative entre l’atrophie meibomienne et la durée de la maladie, ce qui signifie qu’un diagnostic et un traitement précoces sont le meilleur moyen de préserver les glandes meibomiennes. Chez les adultes, de nombreuses études ont démontré une distribution linéaire de l’atrophie des glandes de Meibomius avec l’âge. Dans une population âgée de 25 à 66 ans, Yeotikar et ses associés(31) ont constaté que la prévalence des patients ayant un meiboscore ≥1 était de 72 %. La prévalence des patients ayant un meiboscore de 0 était de 55 % dans la population des 25 à 34 ans, tandis qu’elle était de 10 % dans le groupe des 55 à 66 ans. Selon Zhao et ses collaborateurs(32), cette théorie du vieillissement semble également applicable aux enfants. Chez 266 enfants asymptomatiques, ils ont trouvé une corrélation significative avec l’âge (r = 0,362, P < 0,001).
RÉSULTATS DE L’INTERFÉROMÉTRIE
L’appareil LipiView peut déterminer le LLT par une interférométrie quantitative. Finis et ses associés(15) ont déterminé que sa sensibilité et sa spécificité étaient respectivement de 65,9 % et 63,4 %, avec une valeur normale seuil de 75 nm. Les données du fabricant indiquent une valeur normale seuil de 70 nm.
De manière surprenante, aucune différence entre les LLT des 2 groupes n’a été trouvée dans notre étude. Même l’analyse du sous-groupe des yeux les plus sévères cliniquement et meibographiquement n’a pas montré de valeurs pathologiques. De plus, certains patients cliniquement ou méibographiquement asymptomatiques avaient un faible LLT. Le LLT était seulement significativement corrélé avec le meibum pathologique.
Zhao et ses associés(32) ont étudié le LLT chez des enfants en bonne santé d’un âge moyen de 10,76 ± 1,76 ans en utilisant le LipiView de Tearscience. Ils ont trouvé une corrélation significative entre le LLT d’une part et la distorsion de la glande meibomienne et la perte de la glande d’autre part (r = -0.38, P < .001 et r = -0.17, P = .01, respectivement).
Ce n’était pas le cas chez nos enfants atteints de rosacée oculaire, bien qu’aucune autre étude n’ait analysé la corrélation entre la couche lipidique des larmes et l’altération des glandes meibomiennes dans cette maladie. Chez ces enfants, et à l’exception d’un meibum pathologique, l’inflammation de la surface oculaire et l’atteinte des glandes meibomiennes ne semblent pas avoir d’impact sur la couche lipidique lacrymale.
En conclusion, à notre connaissance, il s’agit de la première étude démontrant une corrélation entre la sévérité clinique et meibographique dans une large population d’enfants atteints de rosacée oculaire. Cette étude confirme que la rosacée oculaire est une maladie sévère responsable de cicatrices cornéennes et de perte de vision chez les enfants, même chez les plus jeunes.
Nous avons été surpris par le taux élevé de malocclusion palpébrale et d’atteinte asymétrique, qui doivent être systématiquement recherchés lors des examens cliniques.
L’interférométrie n’a pas été affectée par la maladie, et le LLT n’était pas corrélé à la sévérité clinique ou à la perte de glandes.
La meibographie est une technique facile, rapide et non invasive qui fournit des informations quasi histologiques sur la morphologie et la densité des glandes de Meibomius. C’est un outil essentiel pour évaluer la gravité de l’atteinte des glandes de Meibomius chez les enfants atteints de rosacée oculaire.
Un certain degré de perte de glande est normal, même chez les enfants en bonne santé. Cependant, la moitié des enfants atteints de rosacée présentaient une perte de glandes > 50 %. Certains jeunes enfants présentaient une perte complète de leurs glandes de Meibomius, ce qui est inquiétant car cette perte n’est probablement pas réversible. Ces enfants pourraient développer des symptômes de sécheresse oculaire à l’avenir. Enfin, le taux de perte des glandes de Meibomius était en corrélation avec la sévérité de la maladie, la durée de la maladie et les antécédents de chalazion.
REFERENCES
- Blépharites Doan S. EMC Ophtalmol. 2012;9(1):1–9.
- Doan S. Recurrent chalazions in children. Rev Prat.2019;69(8):881–883.
- Vieira AC, Mannis MJ. Ocular rosacea: common and commonly missed. J Am Acad Dermatol. 2013;69(6):S36–S41 suppl 1.
- Akpek EK, Merchant A, Pinar V, Foster CS. Ocular rosacea: patient characteristics and follow-up. Cornea.1997;16(2):247.
- Tan J, Berg M. Rosacea: Current state of epidemiology. J Am Acad Dermatol. 2013;69(6):S27–S35 suppl 1.
- Doan S, Gabison E, Gatinel D, Duong M-H, Abitbol O,Hoang-Xuan T. Topical cyclosporine A in severe steroid-de- pendent childhood phlyctenular keratoconjunctivitis. Am J Ophthalmol. 2006;141(1):62–66 e2.
- Thygeson P. The etiology and treatment of phlyctenular ker- atoconjunctivitis. Am J Ophthalmol. 1951;34(9):1217–1236.
- McCann LC, Tomlinson A, Pearce EI, Diaper C. Tear and meibomian gland function in blepharitis and normals. Eye Contact Lens. 2009;35(4):203–208.
- Arita R, Fukuoka S, Morishige N. Functional morphology of the lipid layer of the tear film. Cornea. 2017;36(suppl 1):S60–S66.
- Arita R, Fukuoka S, Morishige N. New insights into the morphology and function of meibomian glands. Exp Eye Res. 2017;163:64–71.
- Ban Y, Shimazaki-Den S, Tsubota K, Shimazaki J. Morpho- logical evaluation of meibomian glands using noncontact in- frared meibography. Ocul Surf. 2013;11(1):47–53.
- Alsuhaibani AH, Carter KD, Abràmoff MD, Nerad JA. Util- ity of meibography in the evaluation of meibomian glands morphology in normal and diseased eyelids. Saudi J Ophthal- mol Off J Saudi Ophthalmol Soc. 2011;25(1):61–66.
- Arita R, Itoh K, Inoue K, Amano S. Noncontact in- frared meibography to document age-related changes of the meibomian glands in a normal population. Ophthalmology. 2008;115(5):911–915.
- Kim HM, Eom Y, Song JS. The relationship between morphology and function of the meibomian glands. Eye Contact Lens. 2018;44(1):1-5.
- Finis D, Pischel N, Schrader S, Geerling G. Evaluation of lipid layer thickness measurement of the tear film as a diagnostic tool for Meibomian gland dysfunction. Cornea. 2013;32(12):1549-1553.
- Suzuki T, Morishige N, Arita R, et al. Morphological changes in the meibomian glands of patients with phlyctenular keratitis: a multicenter cross-sectional study. BMC Ophthalmol. 2016;16(1):178.
- Gonser LI, Gonser CE, Deuter C, Heister M, Zierhut M, Schaller M. Systemic therapy of ocular and cutaneous rosacea in children. J Eur Acad Dermatol Venereol. 2017;31(10):1732-1738.
- Donmez O, Akova YA. Pediatric ocular acne rosacea: clinical features and long term follow-up of sixteen cases. Ocul Immunol Inflamm. 2021;29(1):57-65.
- Jones SM, Weinstein JM, Cumberland P, Klein N, Nischal KK. Visual outcome and corneal changes in children with chronic blepharokeratoconjunctivitis. Ophthalmology. 2007;114(12):2271-2280.
- Korb DR, Baron DF, Herman JP, et al. Tear film lipid layer thickness as a function of blinking. Cornea. 1994;13(4):354-359.
- Finis D, Ackermann P, Pischel N, et al. Evaluation of meibomian gland dysfunction and local distribution of meibomian gland atrophy by non-contact infrared meibography. Curr Eye Res. 2015;40(10):982-989.
- Al-Hayouti H, Daniel M, Hingorani M, Calder V, Dahlman- n-Noor A. Meibography and corneal volume optical coher- ence tomography to quantify damage to ocular structures in children with blepharokeratoconjunctivitis. Acta Ophthalmol. 2019;97(7):e981-e986.
- Yin Y, Gong L. Uneven meibomian gland dropout over the tarsal plate and its correlation with meibomian gland dysfunction. Cornea. 2015;34(10):1200-1205.
- Pult H, Riede-Pult BH, Nichols JJ. Relation between upper and lower lids’ meibomian gland morphology, tear film, and dry eye. Optom Vis Sci. 2012;89(3):E310-E315.
- Machalin ÃÅska A, Zakrzewska A, Markowska A, et al. Morphological and functional evaluation of meibomian gland dysfunction in rosacea patients. Curr Eye Res. 2016;41(8):1029-1034.
- Robin M, Liang H, Baudouin C, LabbeÃÅ A. In vivo meibomian gland imaging techniques: a review of the literature. J Fr Ophtalmol. 2020;43(4):e123-e131.
- Blackie CA, Korb DR, Knop E, Bedi R, Knop N, Holland EJ. Nonobvious obstructive meibomian gland dysfunction. Cornea. 2010;29(12):1333-1345.
- Gupta PK, Stevens MN, Kashyap N, Priestley Y. Prevalence of meibomian gland atrophy in a pediatric population. Cornea. 2018;37(4):426-430.
- Shirakawa R, Arita R, Amano S. Meibomian gland morphology in Japanese infants, children, and adults observed using a mobile pen-shaped infrared meibography device. Am J Ophthalmol. 2013;155(6):1099–1103 e1.
- Wu Y, Li H, Tang Y, Yan X. Morphological evaluation of meibomian glands in children and adolescents using non-contact infrared meibography. J Pediatr Ophthalmol Strabismus. 2017;54(2):78–83.
- Yeotikar NS, Zhu H, Markoulli M, Nichols KK, Naduvilath T, Papas EB. Functional and morphologic changes of meibomian glands in an asymptomatic adult population. Invest Ophthalmol Vis Sci. 2016;57(10):3996–4007.
- Zhao Y, Chen S, Wang S, et al. The significance of meibomian gland changes in asymptomatic children. Ocul Surf. 2018;16(3):301–305.
